
Full resolution (TIFF) - On this page / på denna sida - Varme

<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has been proofread at least once.
(diff)
(history)
Denna sida har korrekturlästs minst en gång.
(skillnad)
(historik)
divideret med Systemets absolutte Temperatur
under Optagelsen — matematisk udtrykt aΣb Q/T
eller b∫a d Q/T — skal have samme Værdi, ad
hvilken reversibel Vej Overgangen end
sker. Men heraf følger, at vi kan opfatte
Integralet b∫a d Q/T som Maal for Tilvæksten ΔS
i en vis Funktion 5, som er bestemt alene af
Legemet og dets Tilstand, men er uafhængig
af, hvordan det er kommet i denne Tilstand.
Denne nye Tilstandsfunktion S kaldte Clausius
Entropien. Det var paa en analog Maade, at
vi sluttede os til Tilstedeværelsen af den
indre Energi U, fordi ogsaa dens Tilvækst
beregnet ved Q og A var uafhængig af
Overgangsvejen. Ligesom Varmeteoriens 1. Hovedsætning
udtrykkes ved den indre Energi U, saaledes
udtrykkes 2. Hovedsætning ved Entropien S,
hvis Tilvækst ΔS beregnes ved ΔS = b∫a dQ/.
Man maa imidlertid lægge Mærke til, at for
at Integralet virkelig skal angive
Entropitilvæksten, maa Processen fra a til b, under
hvilken Varmetilførslerne d Q divideret med den
absolutte Temperatur T opsummeres, være en
reversibel Proces, ellers vil Integralet ikke
have nogen bestemt Værdi. Dette er en
Modsætning til Beregningen af ΔU ved Q og A,
idet Overgangsprocessen der lige saa godt kan
være irreversibel som reversibel.
Entropien af Legemerne i
forskellige Tilstande. Til Orientering over
Entropiændringerne ved et Legemes Ændring
i Tilstand vil vi ligesom ved Oversigten over
den indre Energi begynde med eet Gram af
et fast Legeme med Varmefylden c, der
opvarmes fra T1° K til T2° K. Det kan vises, at
Entropitilvæksten derved bliver T2∫T1 cdT/T = c lognat T2/T1,
det sidste Udtryk forudsætter, at c er
uafhængig af Temperaturen. Samme Udtryk gælder
ogsaa for en Vædskes Entropitilvækst ved
Temperaturændring. Smelter eller fordamper
Legemet ved Temperaturen T, er
Entropitilvæksten ligefrem Smelte- eller
Fordampningsvarmen divideret med T, som jo er konstant
under Processen. Medens Entropi- og
Energitilvæksterne ved de her nævnte
Tilstandsændringer er nogenlunde ensartet forløbende
Størrelser, er der stor Forskel mellem dem ved
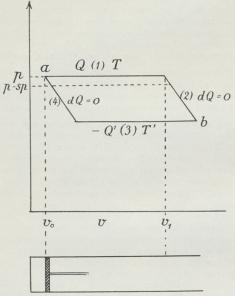
Lufttilstanden. Ligesom Energien vokser Entropien,
naar Luften opvarmes ved konstant Rumfang
— og det efter ovenfor anførte Formel for faste
Legemer og Vædsker — men modsat Energien
afhænger den desuden i høj Grad af
Rumfanget, idet Entropien vokser, naar Rumfanget
vokser. Dette kan vi indse ved at tænke paa
Luftmassen i Cylinderen ved den konstante
Kalorimetertemperatur (se Proces 2 under
Afsnittet: En Luftmasses indre
Energi). Udvider den sig reversibelt, skal der
tilføres den en Varmemængde, som er ækvivalent
med det udførte Arbejde, altsaa maa efter
Entropidefinitionen Luftmassens Entropi forøges
med den tilførte Varmemængde divideret
med Temperaturen. Trykkes den derimod
sammen (som i Proces 2), afgiver den V., og dens
Entropi formindskes. Ved samme Temperatur
har altsaa sammentrykket Luft mindre
Entropi, end hvis den var ved almindelig Tryk,
medens Energien er ens i begge Tilfælde.
Betragter vi til Slut Forbrændingen af 1 g Kul
til Kultveilte, hvorved der ved almindelig
Temperatur afgives c. 8000 Kalorier, saa kunde
man tro, at Entropien af Kultveilten er saa
meget mindre end i Begyndelsestilstanden, Kul
plus Ilt, som den afgivne Varmemængde
divideret med den absolutte Temperatur. Men dette
er netop et Eksempel paa en irreversibel
Proces, og den kan derfor ikke anvendes til
Entropiberegning. Man maa for at bestemme
Entropiændringen finde paa en — i dette Tilfælde
kun tænkt, og ikke realiseret — reversibel
Maade at udføre Overgangen paa. Man har da
beregnet, at Kultveilten ved almindelig
Temperatur omtrent har samme Entropi som Kul plus
Ilt. Derimod kan Omgivelsernes Entropitilvækst
meget nær maales ved den af Processen
afgivne Varmemængde divideret med deres
 |
| Fig. 3. |
 |
| Fig. 4. |
<< prev. page << föreg. sida << >> nästa sida >> next page >>