
Full resolution (TIFF) - On this page / på denna sida - Häfte 5. Maj 1934 - Sven Brennert: Metallbeläggningar som korrosionsskydd på järn
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has been proofread at least once.
(diff)
(history)
Denna sida har korrekturlästs minst en gång.
(skillnad)
(historik)
ädel yta än om den kopplas mot en förhållandevis
oädel sådan. Men man bör, om det gäller att bedöma
ett praktiskt fall, avhålla sig från att teoretisera över
denna fråga och istället utföra direkta försök.
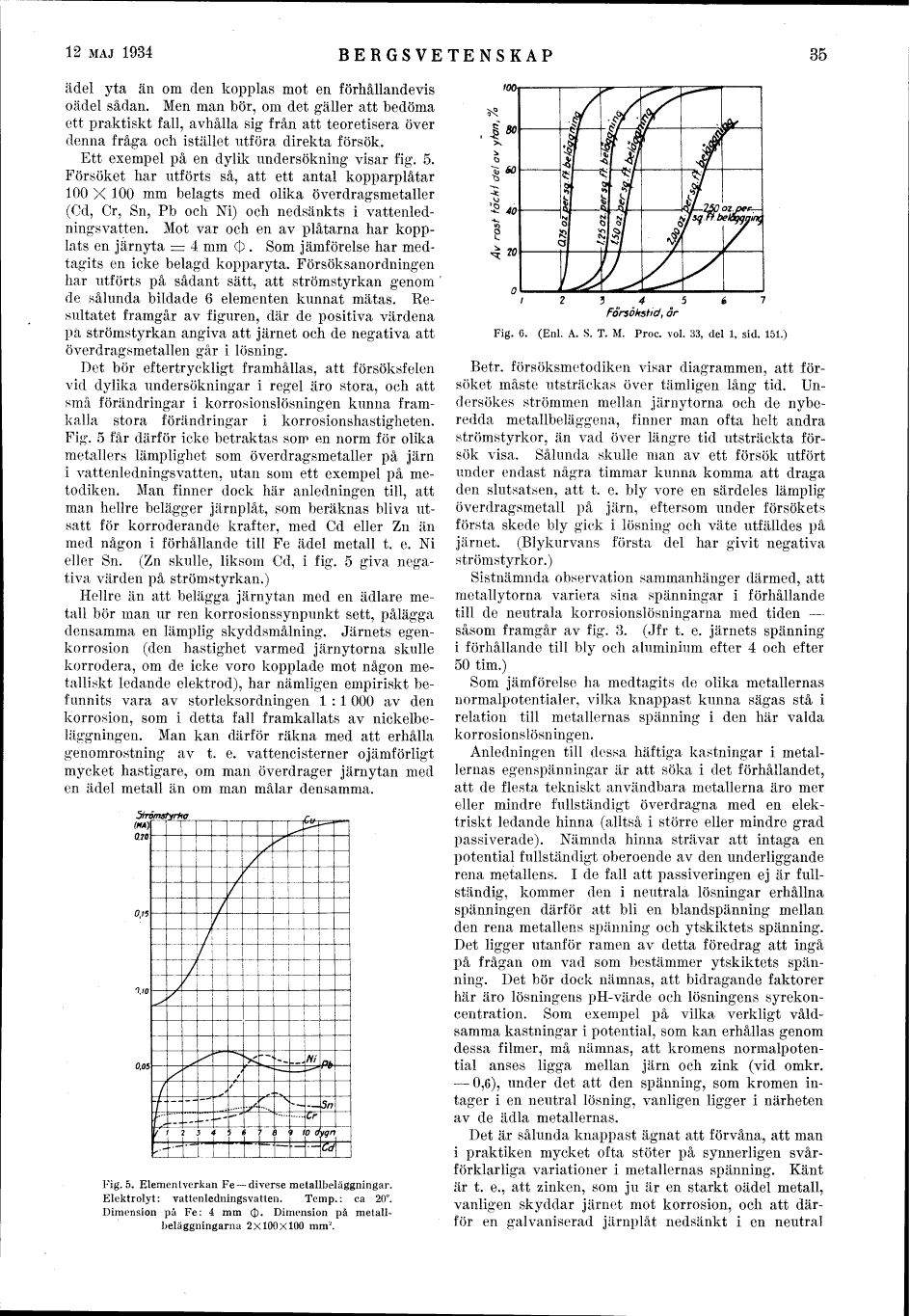
Ett exempel på en dylik undersökning visar fig. 5.
Försöket har utförts så, att ett antal kopparplåtar
100 X 100 mm belagts med olika överdragsmetaller
(Cd, Cr, Sn, Pb och Ni) och nedsänkts i
vattenledningsvatten. Mot var och en av plåtarna har
kopplats en järnyta = 4 mm (|) . Som jämförelse har
medtagits en icke belagd kopparyta. Försöksanordningen
har utförts på sådant sätt, att strömstyrkan genom
de sålunda bildade 6 elementen kunnat mätas.
Resultatet framgår av figuren, där de positiva värdena
pä strömstyrkan angiva att järnet och de negativa att
överdragsmetallen går i lösning.
Det bör eftertryckligt framhållas, att försöksfelen
vid dylika undersökningar i regel äro stora, och att
små förändringar i korrosionslösningen kunna
framkalla stora förändringar i korrosionshastigheten.
Fig. 5 får därför icke betraktas som en norm för olika
metallers lämplighet som överdragsmetaller på järn
i vattenledningsvatten, utan som ett exempel på
metodiken. Man finner dock här anledningen till, att
man hellre belägger järnplåt, som beräknas bliva
utsatt för korroderande krafter, med Cd eller Zn än
med någon i förhållande till Fe ädel metall t. e. Ni
eller Sn. (Zn skulle, liksom Cd, i fig. 5 giva
negativa värden på strömstyrkan.)
Hellre än att belägga järnytan med en ädlare
metall bör man ur ren korrosionssynpunkt sett, pålägga
densamma en lämplig skyddsmålning. Järnets
egenkorrosion (den hastighet varmed järnytorna skulle
korrodera, om de icke voro kopplade mot någon
metalliskt ledande elektrod), har nämligen empiriskt
befunnits vara av storleksordningen 1:1 000 av den
korrosion, som i detta fall framkallats av
nickelbeläggningen. Man kan därför räkna med att erhålla
genomrostning av t. e. vattencisterner ojämförligt
mycket hastigare, om man överdrager järnytan med
en ädel metall än om man målar densamma.
 |
Fig. 5. Elementverkan Fe–diverse metallbeläggningar. Elektrolyt: vattenledningsvatten. Temp.: ca 20°. Dimension på Fe: 4 mm (|). Dimension på metallbeläggningarna 2 X 100 X 100 mm2. |
 |
Fig. 6. (Enl. A. S. T. M. Proc. vol. 33, del 1, sid. 151.) |
<< prev. page << föreg. sida << >> nästa sida >> next page >>