
Full resolution (JPEG) - On this page / på denna sida - 1962, H. 10 - Kloratelektrolysens teori, av Gösta Wranglén
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
Kloratelektrolysens teori
Docent Gösta Wranglén, Stockholm
Klorat framställs genom elektrolys av en
neutral natriumkloridlösning mellan grafitanoder
och stålkatoder i unipolärcell eller mellan
grafitelektroder i bipolärcell. En modern
klorat-cell består i själva verket av en hypokloritcell,
medan kloratet bildas huvudsakligen rent
kemiskt i en efterföljande reaktor. De teoretiska
förutsättningarna lämnar vida gränser, inom
vilka en teknisk-ekonomisk optimering av
processen kan ske.
Huvudreaktioner
Huvudreaktionerna vid processen kan skrivas:
vid anoden:
2 cr—► Cl2 (löst) + 2 e", e0 = + 1,36 V (1)
vid katoden:
2 H20 + 2 e"’ —-> H2 + 2 OH", e0 = — 0,82 (2)
i cellen:
Cl2 (löst) + 2 OH" —> CIO" + Cl" + H20 (3)
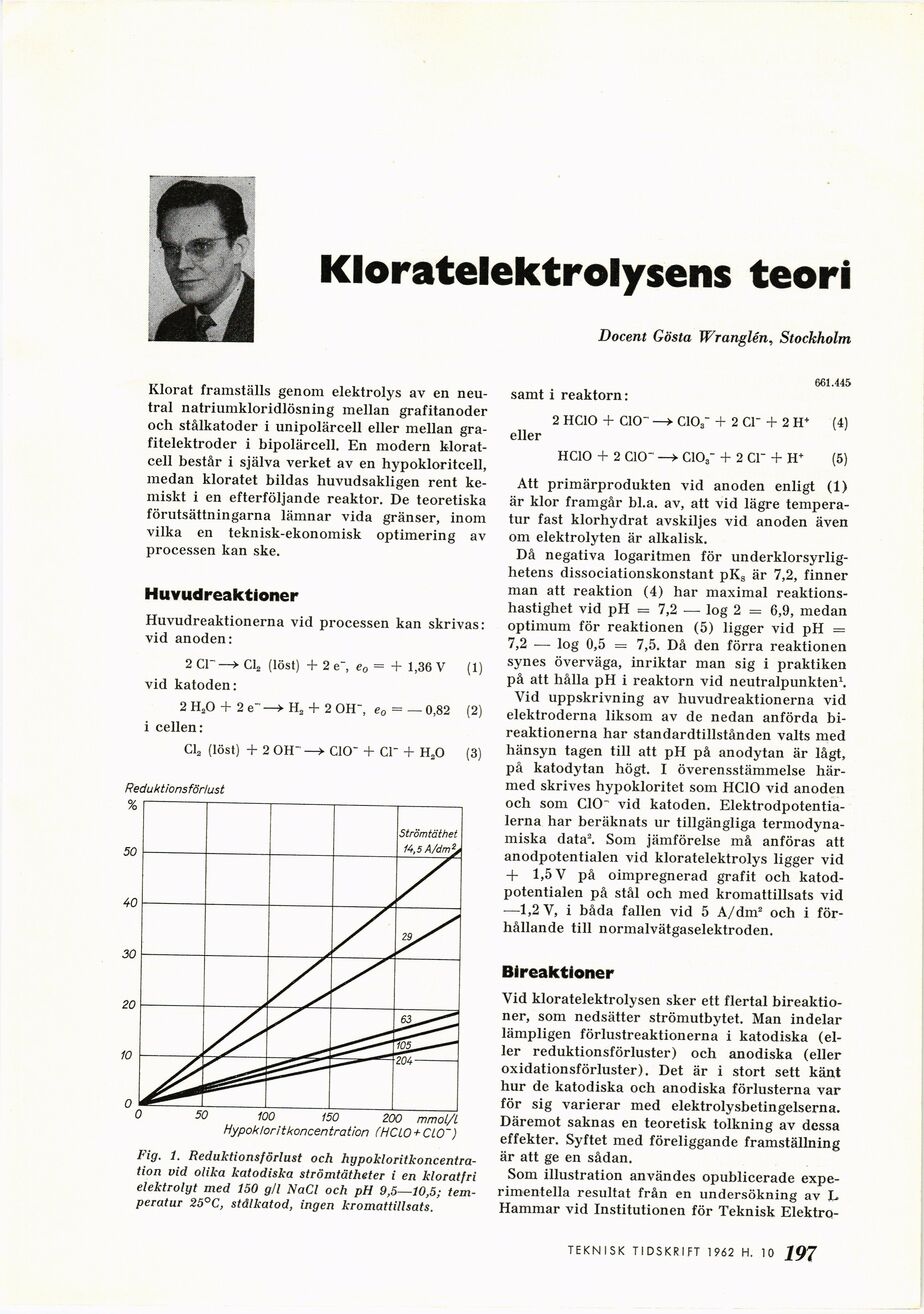
Reduktionsförlust
0 50 100 150 200 mmoi/L
Hypoklor it koncentration (HCLO + ClO~)
Fig. 1. Reduktionsförlust och
hypokloritkoncentra-tion vid olika katodiska strömtätheter i en kloratfri
elektrolyt med 150 gli NaCl och pH 9,5—10,5;
temperatur 25°C, stälkatod, ingen kromattillsats.
661.445
samt i reaktorn:
2 HCIO + CIO" —» C103" + 2 Cl" + 2 H* (4)
eller
HCIO + 2 CIO" —> C103- + 2 Cl" + H* (5)
Att primärprodukten vid anoden enligt (1)
är klor framgår bl.a. av, att vid lägre
temperatur fast klorhydrat avskiljes vid anoden även
om elektrolyten är alkalisk.
Då negativa logaritmen för
underklorsyrlig-hetens dissociationskonstant pKs är 7,2, finner
man att reaktion (4) har maximal
reaktionshastighet vid pH = 7,2 — log 2 = 6,9, medan
optimum för reaktionen (5) ligger vid pH =
7,2 — log 0,5 = 7,5. Då den förra reaktionen
synes överväga, inriktar man sig i praktiken
på att hålla pH i reaktorn vid neutralpunkten1.
Vid uppskrivning av huvudreaktionerna vid
elektroderna liksom av de nedan anförda
bi-reaktionerna har standardtillstånden valts med
hänsyn tagen till att pH på anodytan är lågt,
på katodytan högt. I överensstämmelse
härmed skrives hypokloritet som HCIO vid anoden
och som CIO" vid katoden.
Elektrodpotentialerna har beräknats ur tillgängliga
termodynamiska data3. Som jämförelse må anföras att
anodpotentialen vid kloratelektrolys ligger vid
+ 1,5 V på oimpregnerad grafit och
katod-potentialen på stål och med kromattillsats vid
-—1,2 V, i båda fallen vid 5 A/dm2 och i
förhållande till normalvätgaselektroden.
Bireaktioner
Vid kloratelektrolysen sker ett flertal
bireaktioner, som nedsätter strömutbytet. Man indelar
lämpligen förlustreaktionerna i katodiska
(eller reduktionsförluster) och anodiska (eller
oxidationsförluster). Det är i stort sett känt
hur de katodiska och anodiska förlusterna var
för sig varierar med elektrolysbetingelserna.
Däremot saknas en teoretisk tolkning av dessa
effekter. Syftet med föreliggande framställning
är att ge en sådan.
Som illustration användes opublicerade
experimentella resultat från en undersökning av L
Hammar vid Institutionen för Teknisk Elektro-
TEKNISK TIDSKRIFT 1962 H. 9 j[f}3
<< prev. page << föreg. sida << >> nästa sida >> next page >>