
Full resolution (JPEG) - On this page / på denna sida - 1962, H. 10 - Kloratelektrolysens teori, av Gösta Wranglén
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
kemi, KTH. Vid den studerades
strömutbytes-förlusterna i alkalisk lösning, där den kemiska
kloratbildningen enligt reaktionerna (4) och
(5) är låg, varigenom konstanta
elektrolysbe-tingelser lättare kunde innehållas.
Elektroderna utgjordes av två koncentriska cylindrar,
varvid anoden (av grafit) omgav katoden (av
stål). Genom att variera diametern på
katod-cylindern kunde den katodiska strömtätheten
varieras inom vida gränser vid
konstantförhållande av anodisk strömtäthet och
strömkoncentration i elektrolyten.
Man använde hög katodisk strömtäthet för att
simulera den i praktiken vanliga
kromattillsat-sen. Tidigare undersökningar hade nämligen
visat, att tillsats av kromat medför svårigheter
att reproducera försöksresultaten. Cellen var
sluten och utbytesförlusterna bestämdes på
vanligt sätt genom gasanalys. I vad avser
reduktionsförlusterna bekräftas Hammars
resultat av en nyligen publicerad japansk
undersökning3.
Reduktionsförluster (katodiska
förluster)
Reduktionsförlusterna, som genomgående
uppträder vid katoden, beror tydligen på en
förstöring av närvarande oxidationsmedel,
nämligen genom
reduktion av hypoklorit:
CIO" + H.O + 2 e" —> Cl" + 2 Ott",
e0= + 0,89 (6)
och reduktion av klorat:
CKV + 3 H.O + 6 e" —> Cl" + 6 OH+,
e0 = + 0,63 (7)
Hypoklorit reduceras avsevärt mycket lättare
än klorat i överensstämmelse med dessa joners
kända kemiska egenskaper.
Experimentellt har visats att
reduktionsförlusten
ökar proportionellt med hypoklorithalten
(HCIO + CIO"), fig. 1 och 2;
är tillnärmelsevis omvänt proportionell mot
strömtätheten, fig. 3;
stiger långsamt (ca 3 % per grad) med
temperaturen, fig. 4;
sjunker vid kromattillsats eller användning av
förkromade katoder;
sjunker vid stigande halt av NaCl och vid
högre hypoklorithalter även med stigande
klorat-halt, fig. 1 och 2;
är oberoende av pH mellan 6,5 och 10,5, om
hypoklorithalten hålles konstant.
Alla dessa effekter kan nu förklaras, om man
antar, att hypokloritreduktionens hastighet
begränsas av den konvektiva diffusionen av
hypoklorit fram till katodytan. Detta antagande
är rimligt, eftersom hypokloritet torde bildas
i elektrolyten huvudmassa genom reaktion
mellan löst klor från anoden och alkali från
katoden. Däremot kan hypoklorithalten
förutsättas vara låg vid elektrodytorna. Vidare är
även i elektrolytens huvudmassa hypoklorit-
Reduktionsförlust
%
10
0
0 50 100 150 mmot/l
Hypok/oritkoncentration (HCIO+CIO’)
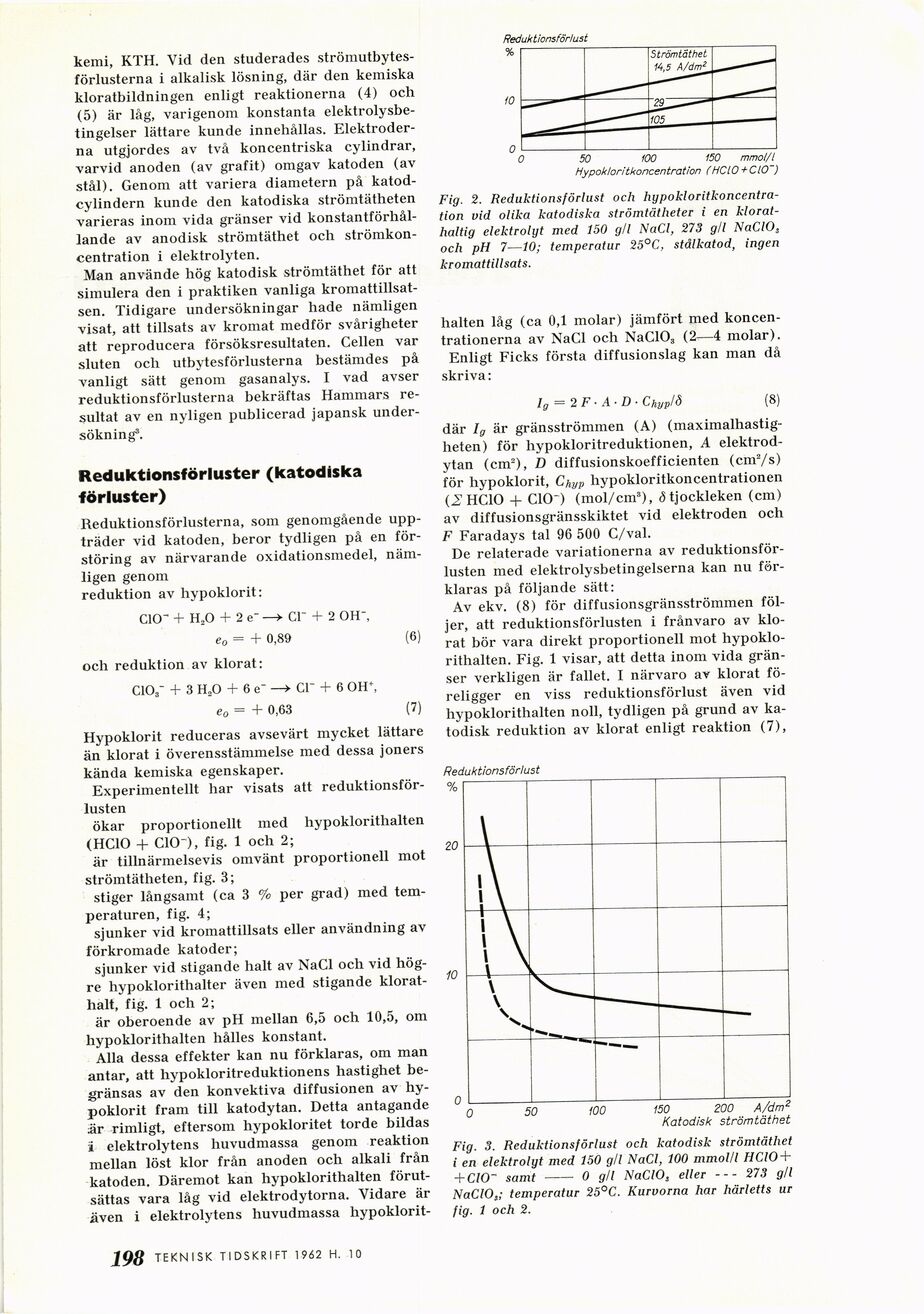
Fig. 2. Reduktionsförlust och
hypokloritkoncentra-tion vid olika katodiska strömtätheter i en
klorat-haltig elektrolyt med 150 g/l NaCl, 273 gli NaClOs
och pH 7—10; temperatur 25°C, stål katod, ingen
kromattillsats.
halten låg (ca 0,1 molar) jämfört med
koncentrationerna av NaCl och NaC103 (2—4 molar).
Enligt Ficks första diffusionslag kan man då
skriva:
Ig = 2 F ■ A- D ■ Chyp/è (8)
där Ig är gränsströmmen (A)
(maximalhastigheten) för hypokloritreduktionen, A
elektrodytan (cm2), D diffusionskoefficienten (cm2/s)
för hypoklorit, Ci,yp hypokloritkoncentrationen
(2 HCIO + CIO") (mol/cm3), å tjockleken (cm)
av diffusionsgränsskiktet vid elektroden och
F Faradays tal 96 500 C/val.
De relaterade variationerna av
reduktionsförlusten med elektrolysbetingelserna kan nu
förklaras på följande sätt:
Av ekv. (8) för diffusionsgränsströmmen
följer, att reduktionsförlusten i frånvaro av
klorat bör vara direkt proportionell mot
hypoklorithalten. Fig. 1 visar, att detta inom vida
gränser verkligen är fallet. I närvaro av klorat
föreligger en viss reduktionsförlust även vid
hypoklorithalten noll, tydligen på grund av
katodisk reduktion av klorat enligt reaktion (7),
Reduktionsförlust
0 50 100 150 200 A/dm2
Katodisk strömtäthet
Fig. 3. Reduktionsförlust och katodisk strömtäthet
i en elektrolyt med 150 g/l NaCl, 100 mmol/l HCIO +
+ CIO- samt–0 g/l NaClO, eller –- 273 g/l
NaClOs; temperatur 25°C. Kurvorna har härletts ur
fig. 1 och 2.
TEKNISK TIDSKRIFT 1 962 H. 9 _/77
<< prev. page << föreg. sida << >> nästa sida >> next page >>