
Full resolution (JPEG) - On this page / på denna sida - *Atom
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
319
Atom
320
Dels genom utvecklingen av de
spektrosko-piska metoderna, dels genom förfinade
mass-spektrografer (se Masspektroskopi,
suppl.) har ett stort antal nya isotoper
upptäckts och isotopvikterna kunnat bestämmas
med stor noggrannhet. Man har på så sätt
funnit avvikelser hos isotopvikterna från
närmaste hela tal (masstalen) ej blott hos väte
utan även hos nästan alla undersökta
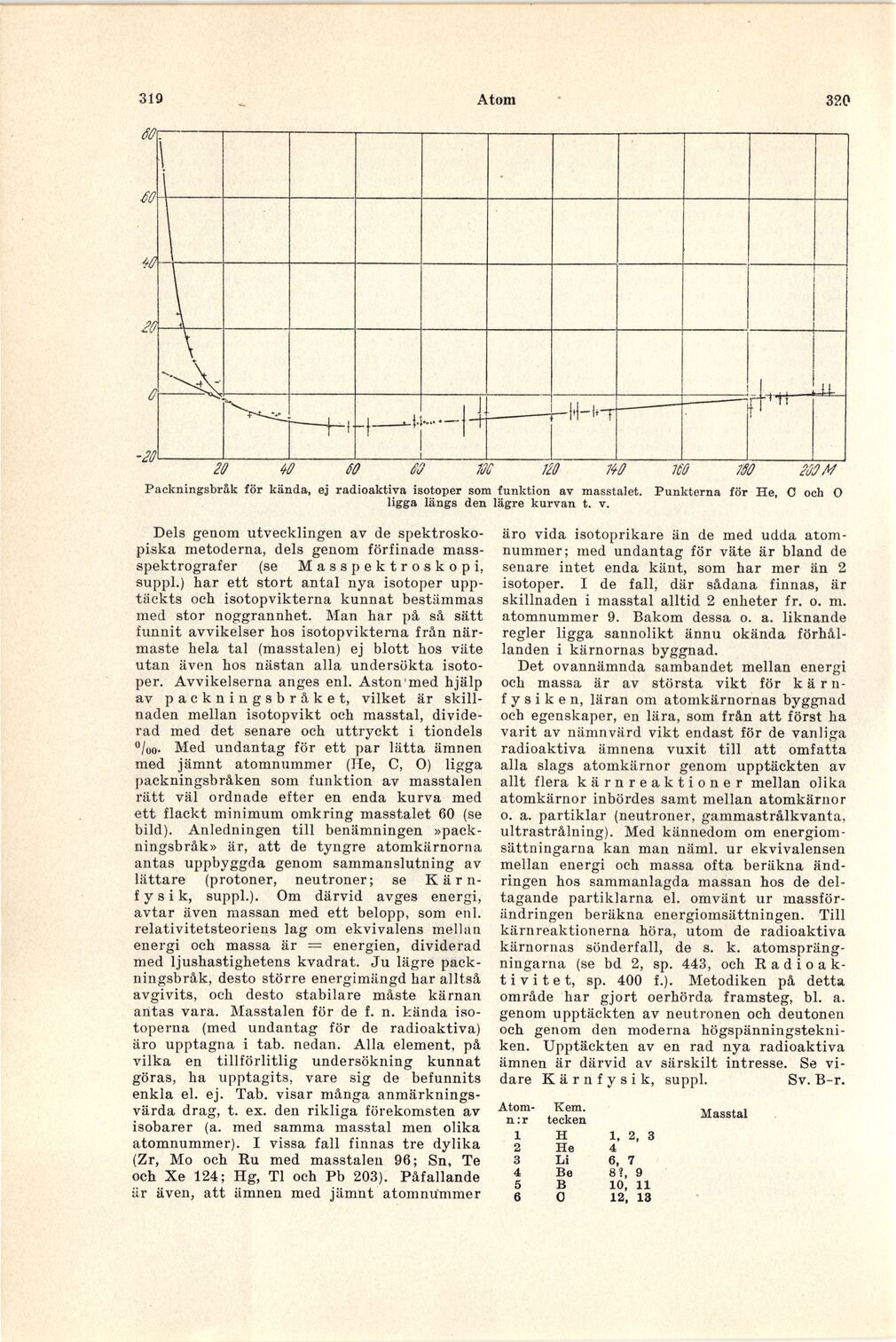
isotoper. Avvikelserna anges enl. Aston med hjälp
av packningsbråket, vilket är
skillnaden mellan isotopvikt och masstal,
dividerad med det senare och uttryckt i tiondels
°/oo. Med undantag för ett par lätta ämnen
med jämnt atomnummer (He, C, O) ligga
packningsbråken som funktion av masstalen
rätt väl ordnade efter en enda kurva med
ett flackt minimum omkring masstalet 60 (se
bild). Anledningen till benämningen
»pack-ningsbråk» är, att de tyngre atomkärnorna
antas uppbyggda genom sammanslutning av
lättare (protoner, neutroner; se
Kärnfysik, suppl.). Om därvid avges energi,
avtar även massan med ett belopp, som enl.
relativitetsteoriens lag om ekvivalens mellan
energi och massa är = energien, dividerad
med ljushastighetens kvadrat. Ju lägre
pack-ningsbråk, desto större energimängd har alltså
avgivits, och desto stabilare måste kärnan
antas vara. Masstalen för de f. n. kända
isotoperna (med undantag för de radioaktiva)
äro upptagna i tab. nedan. Alla element, på
vilka en tillförlitlig undersökning kunnat
göras, ha upptagits, vare sig de befunnits
enkla el. ej. Tab. visar många
anmärkningsvärda drag, t. ex. den rikliga förekomsten av
isobarer (a. med samma masstal men olika
atomnummer). I vissa fall finnas tre dylika
(Zr, Mo och Ru med masstalen 96; Sn, Te
och Xe 124; Hg, TI och Pb 203). Påfallande
är även, att ämnen med jämnt atomnummer
äro vida isotoprikare än de med udda
atomnummer; med undantag för väte är bland de
senare intet enda känt, som har mer än 2
isotoper. I de fall, där sådana finnas, är
skillnaden i masstal alltid 2 enheter fr. o. m.
atomnummer 9. Bakom dessa o. a. liknande
regler ligga sannolikt ännu okända
förhållanden i kärnornas byggnad.
Det ovannämnda sambandet mellan energi
och massa är av största vikt för
kärnfysiken, läran om atomkärnornas byggnad
och egenskaper, en lära, som från att först ha
varit av nämnvärd vikt endast för de vanliga
radioaktiva ämnena vuxit till att omfatta
alla slags atomkärnor genom upptäckten av
allt flera kärnreaktioner mellan olika
atomkärnor inbördes samt mellan atomkärnor
o. a. partiklar (neutroner, gammastrålkvanta,
ultrastrålning). Med kännedom om
energiomsättningarna kan man näml, ur ekvivalensen
mellan energi och massa ofta beräkna
ändringen hos sammanlagda massan hos de
deltagande partiklarna el. omvänt ur
massför-ändringen beräkna energiomsättningen. Till
kärnreaktionerna höra, utom de radioaktiva
kärnornas sönderfall, de s. k.
atomsprängningarna (se bd 2, sp. 443, och
Radioaktivitet, sp. 400 f.). Metodiken på detta
område har gjort oerhörda framsteg, bl. a.
genom upptäckten av neutronen och deutonen
och genom den moderna
högspänningstekni-ken. Upptäckten av en rad nya radioaktiva
ämnen är därvid av särskilt intresse. Se
vidare Kärnfysik, suppl. Sv. B-r.
[-Atom-n:r-]
{+Atom-
n:r+}
Kem.
tecken
Masstal
1 H 1. 2, 3
2 He 4
3 Li 6, 7
4 Be 8?, 9
5 B 10, 11
6 O 12, 13
Packningsbråk för kända, ej radioaktiva isotoper som funktion av masstalet. Punkterna för He, C och O
ligga längs den lägre kurvan t. v.
<< prev. page << föreg. sida << >> nästa sida >> next page >>