
Full resolution (TIFF) - On this page / på denna sida - periodiske System
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has been proofread at least once.
(diff)
(history)
Denna sida har korrekturlästs minst en gång.
(skillnad)
(historik)
kun muligt her at omtale enkelte Grundtræk og
Resultater.
Under Indfangningen af en Elektron af en
Kerne bevæger Elektronen sig i Spring mellem
stationære Tilstande for til sidst at ende i den
Bane, der svarer til den stærkest mulige
Binding af Elektronen. Et uforstyrret Brintatom
bestaar derfor af en Brintkerne og en Elektron
i en 11-Bane. I Helium (Atomnummer 2) maa
man antage, at to Elektroner bevæger sig i
symmetriske 11-Baner. Ved Lithium
(Atomnummer 3) vil to Elektroner bevæge sig paa samme
Maade som i He i 11-Baner, hvorimod den
tredie Elektron ikke mere kan faa Plads til at
bevæge sig i en 11-Bane, men maa bevæge sig i
den større 21-Bane. Denne Bane er nemlig den
Bane, der næst efter 11-Banerne vil svare til
den stærkeste Binding af Elektronen. En Følge
af den tredie Elektrons Særstilling, og løsere
Binding end de to øvrige Elektroner, bliver, at
Lithium let mister denne Elektron, og altsaa er
monovalent og elektropositivt. At Elektronen
bindes i en elliptisk 21-Bane og ikke i en
cirkulær 22-Bane ses, iflg. den Bohr’ske Teori,
direkte af Lithiums Spektrum (se
Spektralanalyse).
Ved næste Stof Beryllium (Atomnummer 4) er
de to inderste Elektroner stadig bundne i
11-Baner, medens de to andre er løsere bundne i
21-Baner. Af Spektret af Kulstof (6) kan det
ses, at i Kulstof er to Elektroner i 11-Baner, to
i 21- og to i 22-Baner. Fortsættes gennem de
næste Stoffer møder man ved Neon (10) en i
n-aktiv Luftart ligesom Helium. Disse
Stoffers kem. Inaktivitet føres tilbage til, at der i
disse Stoffer findes en saadan
Elektronkonfiguration, at det ikke, som i de kem. aktive
Grundstoffer, er let at fjerne en ell. flere af de
Elektroner, der danner Atomets »Overflade«, men at
de yderst liggende Elektroner alle er temmeligt
fast bundne. Dette kan iflg. Bohr’s Teori bedst
tænkes at hidrøre fra, at der i Ordningen af
Elektronbanerne er en saadan høj Grad af
Symmetri til Stede, at der opstaar et saa nøje
Sammenspil mellem de enkelte
Elektronbevægelser, at de Kræfter, der sædvanlig kommer
til Virksomhed under kem. Processer, er for
smaa til at bryde en saadan symmetrisk
Elektronkonfiguration. I Heliumatomet var det
saaledes en Gruppe paa to 11-Elektronbaner. I
Neon findes uden om den »afsluttede«
symmetriske Gruppe paa to 11-Baner en anden
Gruppe paa fire 21-Baner og fire 22-Baner. At en
saadan Gruppe paa 4 + 4 Elektroner maa
besidde en høj Grad af Symmetri, forstaas ud fra
den Betragtning, at to Tetraedre kan anbringes
smukt symmetrisk i hinanden.
Den store Stabilitet og særegne »afsluttede«
Beskaffenhed af Elektronkonfigurationen hos de
inaktive Luftarter ses ogsaa tydeligt af de
omkringliggende Grundstoffer. Som det fremgaar
af det periodiske System, mister Grundstoffer
med et Atomnummer højere end en inaktiv
Luftart let de overskydende Elektroner og
danner en positiv Ion med en Elektronkonfiguration,
der fuldstændig svarer til en inaktiv Luftarts.
Grundstoffer med et Atomnummer lavere end
en inaktiv Luftart optager let en ell. fl.
Elektroner i et saadant Antal, at der kan dannes
en symmetrisk afsluttet Elektrongruppe.
Efter Neon følger i det p. S. Natrium
(Atom-nummer 11). Na-Atomet bestaar af 10
Elektroner i Neonkonfiguration og en løsere bundet
ellevte Elektron; denne kan ikke bevæge sig i
Baner svarende til de otte 21- og 22-Elektroners
Baner og kan derfor kun, som Spektret viser,
bindes i den større 31-Bane. I Fig. 3 er
skematisk vist Atombygningen hos Neon, Natrium og
Argon. Paa Figuren er alle Banerne tegnet i
Planet, hvorimod Banerne i Atomerne jo er
fordelt symmetrisk i Rummet. I de efter Na flg.
Stoffer er de ydre Elektroner bundne i 31- og
32-Baner indtil Argon (18), hvor det er flg.
symmetriske Konfiguration: to 11-, fire 21- og fire
22- samt fire 31- og fire 32-Baner (smlg. Fig. 3).
Efter Argon kommer Kalium (19). Den løsest
bundne Elektron i K bindes ikke i en 33-Bane,
som det maaske kunde ventes; men baade
Spektret og Kaliums store Analogi med Na og
Li viser, at den 19. Elektron i Kalium, maa
findes i en Bane, hvis Bikvantetal k er lig med
1. Af saadanne Baner vil den, hvori Elektronen
bindes fastest, og som ikke allerede er besat,
være en 41-Bane. I Kalcium (20) findes uden
om de 18 Elektroner i Argonkonfiguration to
Elektroner i 41-Baner svarende til Kalciums
divalente Egenskaber.
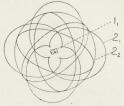 |
| Fig. 3. Hovedtræk af Atombygningen, skematisk. |
<< prev. page << föreg. sida << >> nästa sida >> next page >>