
Full resolution (TIFF) - On this page / på denna sida - Røntgenstraaler

<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has been proofread at least once.
(diff)
(history)
Denna sida har korrekturlästs minst en gång.
(skillnad)
(historik)
Elektroner. Det viser sig, at Linierne kan ikke
fremkaldes enkeltvis, enten kommer der ikke
en eneste af K-Linierne, ell. ogsaa kommer de
alle. Først naar de indfaldende Elektroner har
Energi nok til at fremkalde den haardeste af
Linierne i Gruppen, kommer hele Gruppen, men
saa kommer ogsaa altid hele Gruppen og altid
med det samme indbyrdes Intensitetsforhold,
selv om de fremkaldende Elektroner har meget
stærkere Fart. Den Styrke, hvormed hele
Liniegruppen fremkommer, afhænger af, hvor meget
Spændingen V paa Røret overskrider den
Tærskelspænding V0, der netop giver Elektronerne
den nødvendige Fart; Intensiteten er omtr.
proportional med (V—V0)3/2. For L-, M- o. s. v.
Gruppernes Fremkomst gælder lign.
Betingelser, kun er disse Grupper ikke Helheder, men
falder i flere Undergrupper, L-Gruppen
saaledes i 3. Naar en Elektron har Fart nok til at
fremkalde den haardeste Linie i den første
(blødeste) af disse Undergrupper, kommer hele
denne Undergruppe; faar Elektronen saa megen
Fart, at den kan fremkalde den haardeste Linie
i den næste Undergruppe, kommer ogsaa hele
denne Undergruppe, men den første
Undergruppe bliver ved med ogsaa at komme; faar
endelig Elektronen Fart nok til at fremkalde
den haardeste Linie i 3. Liniegruppe, kommer
ogsaa hele denne Undergruppe med, saa at
hele L-spektret er fuldt uddannet. Ganske
tilsvarende er Forholdet for M-linierne, hvor der
er 5 Undergrupper. — Den første, der har
optaget R.-spektre og derved aabnet hele dette
Omraade for Forskning, er Moseley (1913); den
videre Udvikling af Kendskabet dertil skyldes
mest Siegbahn og hans Elever. Slægtskabet
mellem de forsk. Grundstoffers Spektre kommer
endnu tydeligere frem end i Fig. 10, naar man
afbilder kvadratrod(v) for en bestemt Linie i hver Gruppe
som Funktion af Atomnummeret, idet man da
faar meget nær en ret Linie. (Sammenlign Fig.
1 i periodiske System, hvor Kurverne
er tegnet for de to stærkeste K-linier, og
hosstaaende Fig. 11, hvor de punkterede Linier
giver Forløbet for den stærkeste Linie i hver
Gruppe.) Vilde man i Stedet tage Atomvægten
som Abscisse (afsat foroven i Fig.), faas de
optrukne uregelmæssige Linier, der viser, at det
ikke er Atomvægten, men Atomnummeret, der
er afgørende. Dette regelmæssige Forløb har
tilladt at afgøre med Sikkerhed, hvor mange
endnu ukendte Grundstoffer der findes, ligesom
man kan forudberegne disse manglende Stoffers
R.-spektre og saaledes straks identificere dem,
hvis de findes. Paa denne Maade er f. Eks.
Stoffet Nr. 72 Hafnium opdaget. —
Forklaringen af alle Forhold vedrørende de
karakteristiske R. vindes let ud fra Bohr’s Forestillinger
om Atomets Bygning. Grundtanken i Bohr’s
Anskuelser om Liniespektrenes Opstaaen er, at
hver Linie udsendes ved, at en Elektron
springer fra en af de mulige Baner i Atomet til en
anden, eller at Atomet gaar over fra en af de
mulige stationære Tilstande til en anden. Den
Energimængde, der derved bliver fri, nemlig
Forskellen mellem Atomets Energi E1 og E2 i
de to Tilstande, udsendes som Straaling af en
bestemt Bølgebredde, bestemt ved
Kvantebetingelsen hv = E1—E2. De haardeste R. maa
komme fra de allerinderste Elektroner i
Atomet, thi kun disse er bundne saa stærkt, at der
ved deres Overgange fra en til en anden mulig
Bane bliver Energi nok fri til at give de meget
store Kvanter, der svarer til de meget korte
Bølgebredder. Desuden viser det nære
Slægtskab mellem de forsk. Stoffers R.-spektre hen
til, at det er de indre Elektroner, der er
virksomme, fordi Atomets inderste Del er ens fra
Stof til Stof, bortset fra at Kernens Ladning
stiger en for hvert Nr. i det periodiske System.
Derimod er de kem. Egenskaber og f. Eks. de
optiske Spektre, der varierer periodisk paa
bestemt Maade op gennem det periodiske
System, knyttet til de yderste Elektroner, i hvis
Opbygning der ogsaa er en vis Periodicitet.
Et Atom bestaar af en Kerne, hvis Ladning er
lige saa mange Elementarkvanter af positiv
Elektricitet, som Atomets Nr. angiver, og
derudenom lige saa mange Elektroner, saa at
Atomet bliver elektrisk neutralt. Disse
Elektroner falder (sammenlign Kvanteteori og
periodisk System) i adskilte Grupper,
efter hvor stærkt de er bundne ell. hvor
vanskeligt det er at fjerne dem, altsaa hvor stor
Energi man maa tilføre Atomet for at fjerne
dem. F. Eks. i Stoffet med flest Elektroner, Nr.
92 Uran, findes der inderst om Kernen de to
fastest og lige fast bundne saakaldte
K-Elektroner og derudenom 8 Elektroner i 2
Undergrupper, L-Elektronerne, der er væsentlig
løsere bundne, og saaledes at de to
Undergrupper er lidt forsk. bundne. Derefter kommer 18
Elektroner i 3 Undergrupper, M-Elektronerne,
32 Elektroner i 4 Grupper, N-Elektronerne og
endelig to Grupper, O- og P-Elektronerne, der
ikke engang er helt udfyldte i Uran. Gaar vi
nedad i det periodiske System, bliver de
yderste Grupper mindre og mindre fuldstændige,
idet det dog ikke er saadan, at alle indre
Grupper er fuldt uddannede, før en ydre Gruppe
begynder at optræde; tværtimod vil, naar en
indre Gruppe har naaet en midlertidig relativ
Fuldstændighed, en ydre Gruppe kunne
begynde at optræde, og først senere hører den videre
Uddannelse af denne Gruppe op, og den indre
fortsætter Fuldstændiggørelsen. Et saaledes
bygget Atom er yderst skematisk antydet i Fig. 12,
hvor Cirklerne symboliserer de forsk. Grupper
af Elektroner uden om Kernen. Vi maa nu
tænke os, at en K-Linie opstaar, ved at der
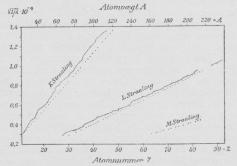 |
| Fig. 11. Røntgenspektrenes Afhængighed af Atomnummeret. |
<< prev. page << föreg. sida << >> nästa sida >> next page >>