
Full resolution (TIFF)
- On this page / på denna sida
- Häfte 5. 30 jan. 1932
- Om framställning av smidbart järn direkt ur malm, av Bo Kalling
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has been proofread at least once.
(diff)
(history)
Denna sida har korrekturlästs minst en gång.
(skillnad)
(historik)
 |
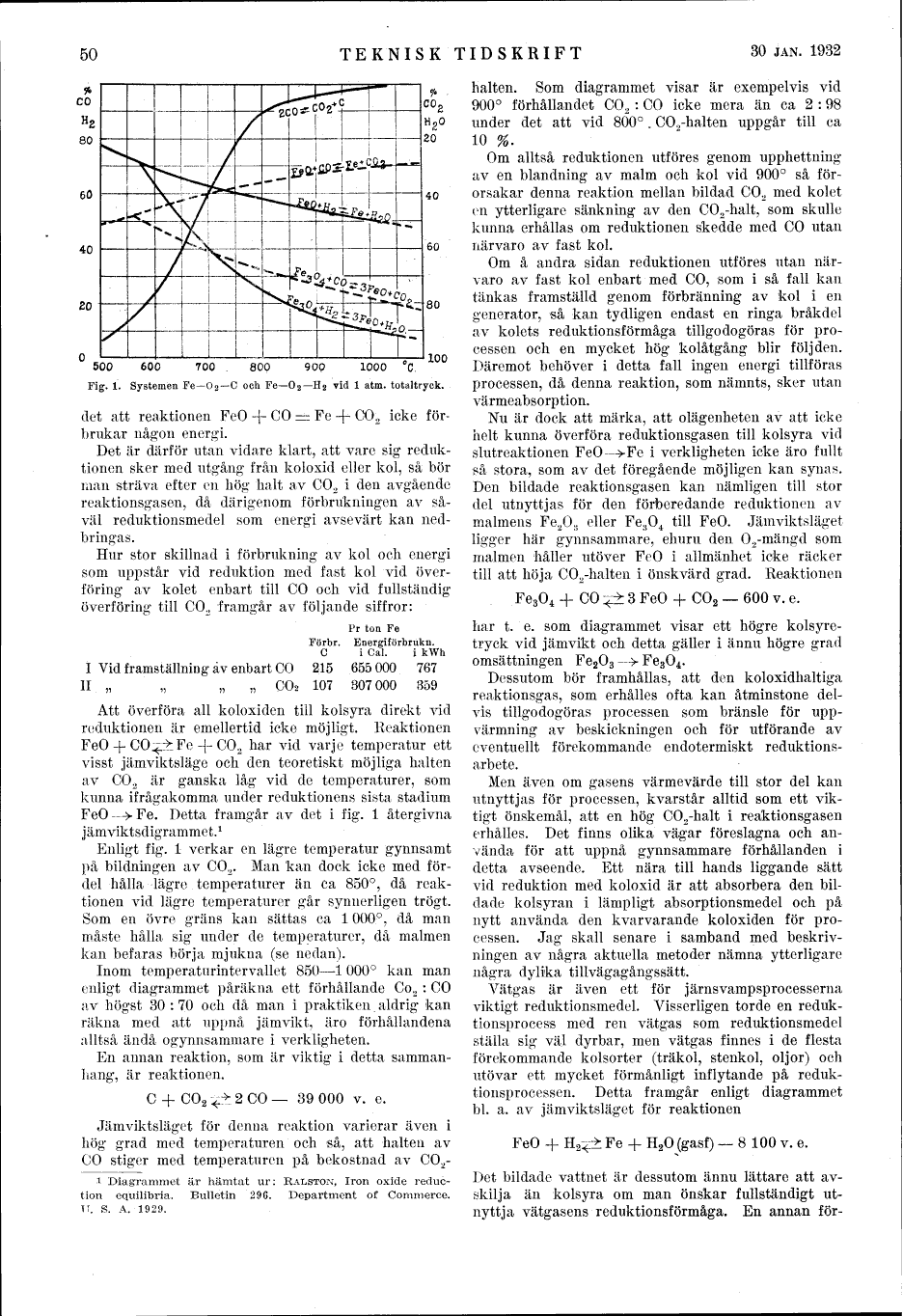
Fig. 1. Systemen Fe–O2–C och Fe-O2– H2 vid 1 atm. totaltryck.
|
det att reaktionen FeO + CO = Fe + CO2 icke
förbrukar någon energi.
Det är därför utan vidare klart, att vare sig
reduktionen sker med utgång från koloxid eller kol, så bör
man sträva efter en hög halt av CO2 i den avgående
reaktionsgasen, då därigenom förbrukningen av
såväl reduktionsmedel som energi avsevärt kan
nedbringas.
Hur stor skillnad i förbrukning av kol och energi
som uppstår vid reduktion med fast kol vid
överföring av kolet enbart till CO och vid fullständig
överföring till CO2 framgår av följande siffror:
| | | | Pr ton Fe | |
| | | Förbr. | Energi | förbrukn. |
| | | C | i Cal. | i kWh |
| I | Vid framställning äv enbart | CO | 215 | 655 000 | 767 |
| II | Vid framställning äv enbart | CO2 | 107 | 307 000 | 359 |
Att överföra all koloxiden till kolsyra direkt vid
reduktionen är emellertid icke möjligt. Reaktionen
FeO + CO–><–Fe + CO2 har vid varje temperatur ett
visst jämviktsläge och den teoretiskt möjliga halten
av CO2 är ganska låg vid de temperaturer, som
kunna ifrågakomma under reduktionens sista stadium
FeO –> Fe. Detta framgår av det i fig. l återgivna
jämviktsdigrammet.[1]
Enligt fig. 1 verkar en lägre temperatur gynnsamt
på bildningen av CO2. Man kan dock icke med
fördel hålla lägre temperaturer än ca 850°, då
reaktionen vid lägre temperaturer går synnerligen trögt.
Som en övre gräns kan sättas ca 1 000°, då man
måste hålla sig under de temperaturer, då malmen
kan befaras börja mjukna (se nedan).
Inom temperaturintervallet 850–1 000° kan man
enligt diagrammet påräkna ett förhållande Co2 : CO
av högst 30 : 70 och då man i praktiken aldrig kan
räkna med att uppnå jämvikt, äro förhållandena
alltså ändå ogynnsammare i verkligheten.
En annan reaktion, som är viktig i detta
sammanhang, är reaktionen.
C + CO2 –><– 2 CO – 39 000 v. e.
Jämviktsläget för denna reaktion varierar även i
hög grad med temperaturen och så, att halten av
CO stiger med temperaturen på bekostnad av CO2-halten.
Som diagrammet visar är exempelvis vid
900° förhållandet CO2 : CO icke mera än ca 2 : 98
under det att vid 800°. CO2-halten uppgår till ca
10 %.
Om alltså reduktionen utföres genom upphettning
av en blandning av malm och kol vid 900° så
förorsakar denna reaktion mellan bildad CO2 med kolet
en ytterligare sänkning av den CO2-halt, som skulle
kunna erhållas om reduktionen skedde med CO utan
närvaro av fast kol.
Om å andra sidan reduktionen utföres utan
närvaro av fast kol enbart med CO, som i så fall kan
tänkas framställd genom förbränning av kol i en
generator, så kan tydligen endast en ringa bråkdel
av kolets reduktionsförmåga tillgodogöras för
processen och en mycket hög kolåtgång blir följden.
Däremot behöver i detta fall ingen energi tillföras
processen, då denna reaktion, som nämnts, sker utan
värmeabsorption.
Nu är dock att märka, att olägenheten av att icke
helt kunna överföra reduktionsgasen till kolsyra vid
slutreaktionen FeO –> Fe i verkligheten icke äro fullt
så stora, som av det föregående möjligen kan synas.
Den bildade reaktionsgasen kan nämligen till stor
del utnyttjas för den förberedande reduktionen av
malmens Fe2O3, eller Fe3O4 till FeO. Jämviktsläget
ligger här gynnsammare, ehuru den O2-mängd som
malmen håller utöver FeO i allmänhet icke räcker
till att höja CO2-halten i önskvärd grad. Reaktionen
Fe3O4 + CO –><– 3 FeO + CO2 – 600 v. e.
har t. e. som diagrammet visar ett högre kolsyretryck
vid jämvikt och detta gäller i ännu högre grad
omsättningen Fe2O3 –> Fe3O4.
Dessutom bör framhållas, att den koloxidhaltiga
reaktionsgas, som erhålles ofta kan åtminstone
delvis tillgodogöras processen som bränsle för
uppvärmning av beskickningen och för utförande av
eventuellt förekommande endotermiskt reduktionsarbete.
Men även om gasens värmevärde till stor del kan
utnyttjas för processen, kvarstår alltid som ett
viktigt önskemål, att en hög CO2-halt i reaktionsgasen
erhålles. Det finns olika vägar föreslagna och
använda för att uppnå gynnsammare förhållanden i
detta avseende. Ett nära till hands liggande sätt
vid reduktion med koloxid är att absorbera den
bildade kolsyran i lämpligt absorptionsmedel och på
nytt använda den kvarvarande koloxiden för
processen. Jag skall senare i samband med
beskrivningen av några aktuella metoder nämna
ytterligare några dylika tillvägagångssätt.
Vätgas är även ett för järnsvampsprocesserna
viktigt reduktionsmedel. Visserligen torde en
reduktionsprocess med ren vätgas som reduktionsmedel
ställa sig väl dyrbar, men vätgas finnes i de flesta
förekommande kolsorter (träkol, stenkol, oljor) och
utövar ett mycket förmånligt inflytande på
reduktionsprocessen. Detta framgår enligt diagrammet
bl. a. av jämviktsläget för reaktionen
FeO + H2 –><– Fe + H2O (gasf) – 8 100 v. e.
Det bildade vattnet är dessutom ännu lättare att
avskilja än kolsyra om man önskar fullständigt
utnyttja vätgasens reduktionsförmåga. En annan
[1] Diagrammet är hämtat ur: Ralston, Iron oxide
recluction equilibria. Bulletin 296. Department of Commerce.
U. S. A. 1929.
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Project Runeberg, Fri Oct 18 15:28:19 2024
(aronsson)
(diff)
(history)
(download)
<< Previous
Next >>
https://runeberg.org/tektid/1932a/0060.html




