
Full resolution (JPEG) - On this page / på denna sida - Sidor ...
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
Teknisk Tidskrift
Tryck i 1000 atm.
Fig. 7.
80 JOO
Vikts % alkohol
Fig. 8.
20 VO SO 80
- Vikts % CS2
Fig. 9.
20 tO 60 SO 100
’ Vikts 7b CCL4
Fig. 10.
0 5 10 15 20
—- Koncentration i vikts %
Fig. 11.
100
20 ¥0 60 80 100
-«-Koncentration i vikt5%
Fig. 12.
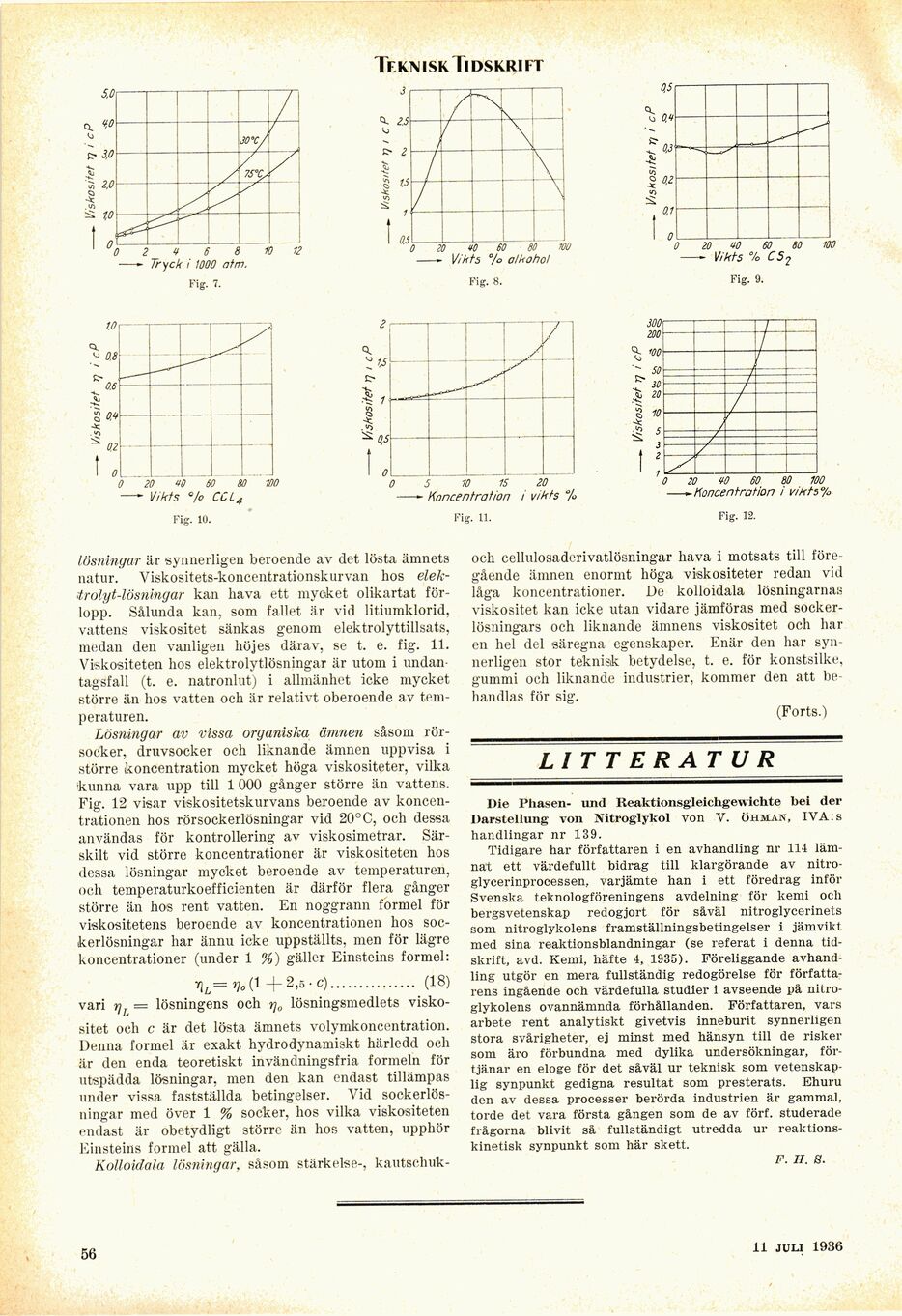
Lösningar är synnerligen beroende av det lösta ämnets
natur. Viskositets-koncentrationskurvan hos
elek-trölyt-lösningar kan hava ett mycket olikartat
förlopp. Sålunda kan, som fallet är vid litiumklorid,
vattens viskositet sänkas genom elektrolyttillsats,
medan den vanligen höjes därav, se t. e. fig. 11.
Viskositeten hos elektrolytlösningar är utom i undan
tagsfall (t. e. natronlut) i allmänhet icke mycket
större än hos vatten och är relativt oberoende av
temperaturen.
Lösningar av vissa organiska ämnen såsom
rörsocker, druvsocker och liknande ämnen uppvisa i
större koncentration mycket höga viskositeter, vilka
kunna vara upp till 1 000 gånger större än vattens.
Fig. 12 visar viskositetskurvans beroende av
koncentrationen hos rörsockerlösningar vid 20°C, och dessa
användas för kontrollering av viskosimetrar.
Särskilt vid större koncentrationer är viskositeten hos
dessa lösningar mycket beroende av temperaturen,
och temperaturkoefficienten är därför flera gånger
större än hos rent vatten. En noggrann formel för
viskositetens beroende av koncentrationen hos
sockerlösningar har ännu icke uppställts, men för lägre
koncentrationer (under 1 %) gäller Einsteins formel:
7^=^(1+2,5.0)............... (18)
vari r/r = lösningens och rj0 lösningsmedlets
viskositet och c är det lösta ämnets volymkoncentration.
Denna formel är exakt hydrodynamiskt härledd och
är den enda teoretiskt invändningsfria formeln för
utspädda lösningar, men den kan endast tillämpas
under vissa fastställda betingelser. Vid
sockerlösningar med över 1 % socker, hos vilka viskositeten
endast är obetydligt större än hos vatten, upphör
Einsteins formel att gälla.
Kolloidala lösningar, såsom stärkelse-, kautschuk-
och cellulosaderivatlösningar hava i motsats till
föregående ämnen enormt höga viskositeter redan vid
låga koncentrationer. De kolloidala lösningarnas
viskositet kan icke utan vidare jämföras med
sockerlösningars och liknande ämnens viskositet och har
en hel del säregna egenskaper. Enär den har
synnerligen stor teknisk betydelse, t. e. för konstsilke,
gummi och liknande industrier, kommer den att
behandlas för sig.
(Forts.)
litteratur
Die Phasen- und Reaktionsgleichgewichte bei der
Parstellung von JJitroglykol von V. öhman, IVA:s
handlingar nr 139.
Tidigare har författaren i en avhandling nr 114
lämnat ett värdefullt bidrag till klargörande av
nitro-glycerinprocessen, varjämte han i ett föredrag inför
Svenska teknologföreningens avdelning för kemi ocli
bergsvetenskap redogjort för såväl nitroglycerinets
som nitroglykolens framställningsbetingelser i jämvikt
med sina reaktionsblandningar (se referat i denna
tidskrift, avd. Kemi, häfte 4, 1935). Föreliggande
avhandling utgör en mera fullständig redogörelse för
författarens ingående och värdefulla studier i avseende på
nitroglykolens ovannämnda förhållanden. Författaren, vars
arbete rent analytiskt givetvis inneburit synnerligen
stora svårigheter, ej minst med hänsyn till de risker
som äro förbundna med dylika undersökningar,
förtjänar en eloge för det såväl ur teknisk som
vetenskaplig synpunkt gedigna resultat som presterats. Ehuru
den av dessa processer berörda industrien är gammal,
torde det vara första gången som de av förf. studerade
frågorna blivit så fullständigt utredda ur
reaktions-kinetisk synpunkt som här skett.
F. H. 8.
56
12 sept. 1936
<< prev. page << föreg. sida << >> nästa sida >> next page >>