
Full resolution (JPEG) - On this page / på denna sida - Atom
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
437
Atom
438
kan binda eller i kemiska föreningar ersätta,
densamma. Atomvärdet i förhållande till syre
stiger med en enhet för varje grupp, i
förhållande till väte stiger värdigheten t. o. m. 4:e
gruppen och avtager sedan igen.
O-gruppen innehåller de indifferenta ädelgaserna.
Betraktar man det periodiska systemet,
finner man redan vid ett hastigt påseende en
del oregelbundenheter. Flera platser äro
tomma, en del grundämnen stå ej i den
ordningsföljd atomvikterna ange. Två sådana i oriktig
ordning stående grundämnen äro t. ex. argon
och kalium. Hur noggrant man än bestämt
deras atomvikter, har man alltid kommit till
en lägre atomvikt för kalium (39,10) än för
argon (39,88). Trots detta har man måst
placera dem på sätt som skett, och detta på
grund av att argon nödvändigt hör samman
med ädelgaserna, kalium med de envärdiga
alkalimetallerna. Då Mendelejev uppställde
sitt periodiska system, voro åtskilliga av våra
nu kända grundämnen ännu ej upptäckta och
luckorna i systemet således betydligt flera än
nu. Dessutom voro avvikelserna på grund av
de många oriktiga atomvikterna, som man då
ännu hade, talrikare. Till följd härav
mottogs Mendelejevs arbete vid sitt första
framträdande endast med ringa intresse, vilket
dock snart förbyttes i ett entusiastiskt
erkännande, särskilt sedan en del grundämnen, som
Mendelejev förutsagt, upptäckts och de av
honom förutberäknade egenskaperna på ett
glänsande sätt bekräftats.
Daltons hypotes, att grundämnena ej
vidare kunna sönderfalla, har ej besannat sig.
Visserligen har det ännu ej lyckats att på
kemisk väg utföra denna spjälkning, men
upptäckten av radium och de radioaktiva
ämnena har visat, att det finnes en hel mängd
grundämnen, som av sig själva sönderfalla.
Dessutom har Rutherford med tillhjälp
av en av honom utarbetad sinnrik metod (se
sp. 443) lyckats sönderdela ett ej så litet
antal av de lättare grundämnena. Att de
övriga skola utgöra något undantag är ej att
förmoda.
Alla de radioaktiva grundämnena kunna
inordnas i två huvudserier: uran-serien
och torium-serien (se Radioaktivitet).
Elementen i varje serie uppkomma genom
successivt sönderfallande eller omvandling av
det första grundämnet i serien. Detta sker
under utstötande av a- eller /i-partiklar.
Varje gång en a-partikel (= en positivt
laddad heliumatom) utstötes, minskas ämnets
atomvikt med 4 (= heliums atomvikt) och
sjunker värdigheten med 2 (a-partikeln bär
2 positiva laddningar). När en /i-partikel
(=en negativ elektron) utstötes, ändras ej
märkbart ämnets massa på grund av elektro-
1
nens ytterst ringa massa (= av
väteatomens), men värdigheten stiger med 1, då
^-partikeln bär en negativ laddning. Vi
skola förtydliga detta med ett par exempel.
Radium sönderfaller i niton under utstötande
av en a-partikel för varje sönderfallande
atom. Radium är 2-värdigt och dess
atomvikt 226, niton 0-värdigt och dess atomvikt
222. Radium B omvandlas i radium C un
der utsändandet av en /hpartikel. Radium
B:s och radium C:s atomvikter äro lika,
medan radium B är 4-värdigt och radium C
5-värdigt. Följden av att än a-strålar, än
/hstrålar utsändas blir, att de nyuppkomna
ämnenas platser i det periodiska systemet i
riktning av avtagande massa än ligga två
platser till vänster, än en plats till höger om
det element, varur det bildats, d. v. s. serien av
sönderdelningsprodukter passerar ej blott en
gång genom en och samma grupp i det
periodiska systemet utan pendlar fram och tillbaka
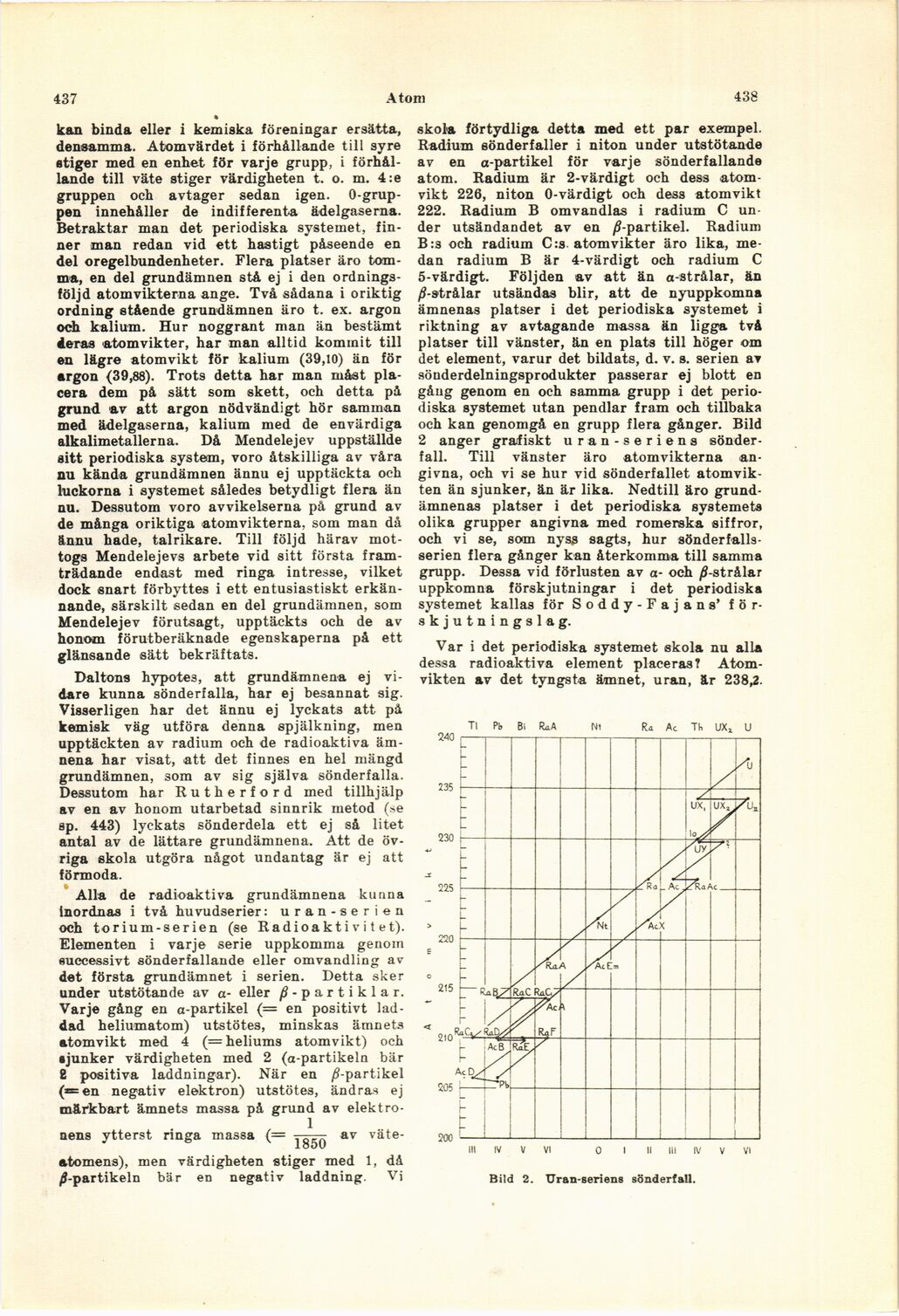
och kan genomgå en grupp flera gånger. Bild
2 anger grafiskt uran-seriens
sönderfall. Till vänster äro atomvikterna
angivna, och vi se hur vid sönderfallet
atomvikten än sjunker, än är lika. Nedtill äro
grundämnenas platser i det periodiska systemets
olika grupper angivna med romerska siffror,
och vi se, som nyss sagts, hur
sönderfalls-serien flera gånger kan återkomma till samma
grupp. Dessa vid förlusten av a- och ^-strålar
uppkomna förskjutningar i det periodiska
systemet kallas för Soddy-Fajans’
förskjutningslag.
Var i det periodiska systemet skola nu alla
dessa radioaktiva element placeras?
Atomvikten av det tyngsta ämnet, uran, är 238,2.
Bild 2. Uran-seriens sönderfall.
<< prev. page << föreg. sida << >> nästa sida >> next page >>