
Full resolution (JPEG) - On this page / på denna sida - Atom
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
443
Atom
444
kunde visa, att även andra grundämnen
kunna sönderfalla. Detta har också helt
nyligen gjorts av Rutherford. Han har
nämligen, såsom förut påpekats, lyckats
spjälka flera grundämnen, nämligen bor,
kväve, fluor, natrium, aluminium
och fosfor. Bildligt talat kunna vi säga,
att han helt enkelt skjutit sönder dessa
element med de vid de radioaktiva ämnenas
omvandlingar utslungade a-partiklarna. En
a-partikel är nämligen, i förhållande till sin
litenhet, den kraftigaste projektil man
känner. Den utskjutes med en hastighet, som
är omkr. 19,200 km i sek., och med en
rörelseenergi, som är 400 mill. gånger större än
den hastigaste gevärskulas, räknad på
mass-enheten. Vid sina spjälkningar kunde
Rutherford överallt påvisa uppträdandet av
väte. Sannolikt bildas även helium. Då även
de radioaktiva grundämnena sönderfalla
under avspjälkning av heliumatomer, så är det
således mycket troligt, att alla grundämnen
äro uppbyggda av väte och helium, och då
helium i sin tur antages vara uppbyggt av
väte, skulle alla ämnen bestå av väteatomer
i olika sammanslutningar. Alkemisternas
gamla dröm att göra guld skulle alltså dock
en gång kunna förverkligas.
Som vi ha sett, är atomvikten ej något för
ett grundämne utmärkande. Men huru
överensstämmer detta med det periodiska
systemet? Att en stor del av grundämnenas
egenskaper är underkastad periodiska
förändringar, är ett experimentellt faktum och står
således utom allt tvivel; periodiciteten måste
bara bero på något annat än på atomvikten.
Att utan vidare förkasta det periodiska
systemet vore därför otänkbart. Under årtionden
har det visat sitt stora värde. Så stodo
sakerna, då forskningar på ett helt annat
område kastade ett nytt ljus på förhållandena.
Genom tysken L au e s och engelsmännen
B r a g g s (far och son) undersökningar
lyckades man för första gången exakt bestämma
röntgenstrålarnas våglängder (se
Röntgenstrålning). Härvid fann man bl. a., att
vissa röntgenstrålar (de s. k.
karakteristiska röntgenstrålarna), som ett
grundämne utsänder, om det bestrålas med
katodstrålar (se d. o.), voro utmärkande för
detsamma. Men då ett grundämnes vanliga
optiska spektrum utmärker sig genom sin
utpräglade periodicitet, äro röntgenspektra
kvalitativt likformigt byggda. Dessutom
utmärka de sig, till skillnad från de
optiska spektra, för stor enkelhet. Genom
engelsmannen B a r k 1 a s och svensken S i e
g-b a h n s undersökningar har fastställts, att
grundämnenas röntgenspektra utgöras av 3
olika serier av linjer, K-, L- och M-serierna,
vilka för alla grundämnena visa en analog
byggnad. Dessutom ha, enligt
undersökningar av holländaren Coster m. fl., även
för vissa element N-, O- och P-serier
upptäckts. Endast svängningstalen för motsva-
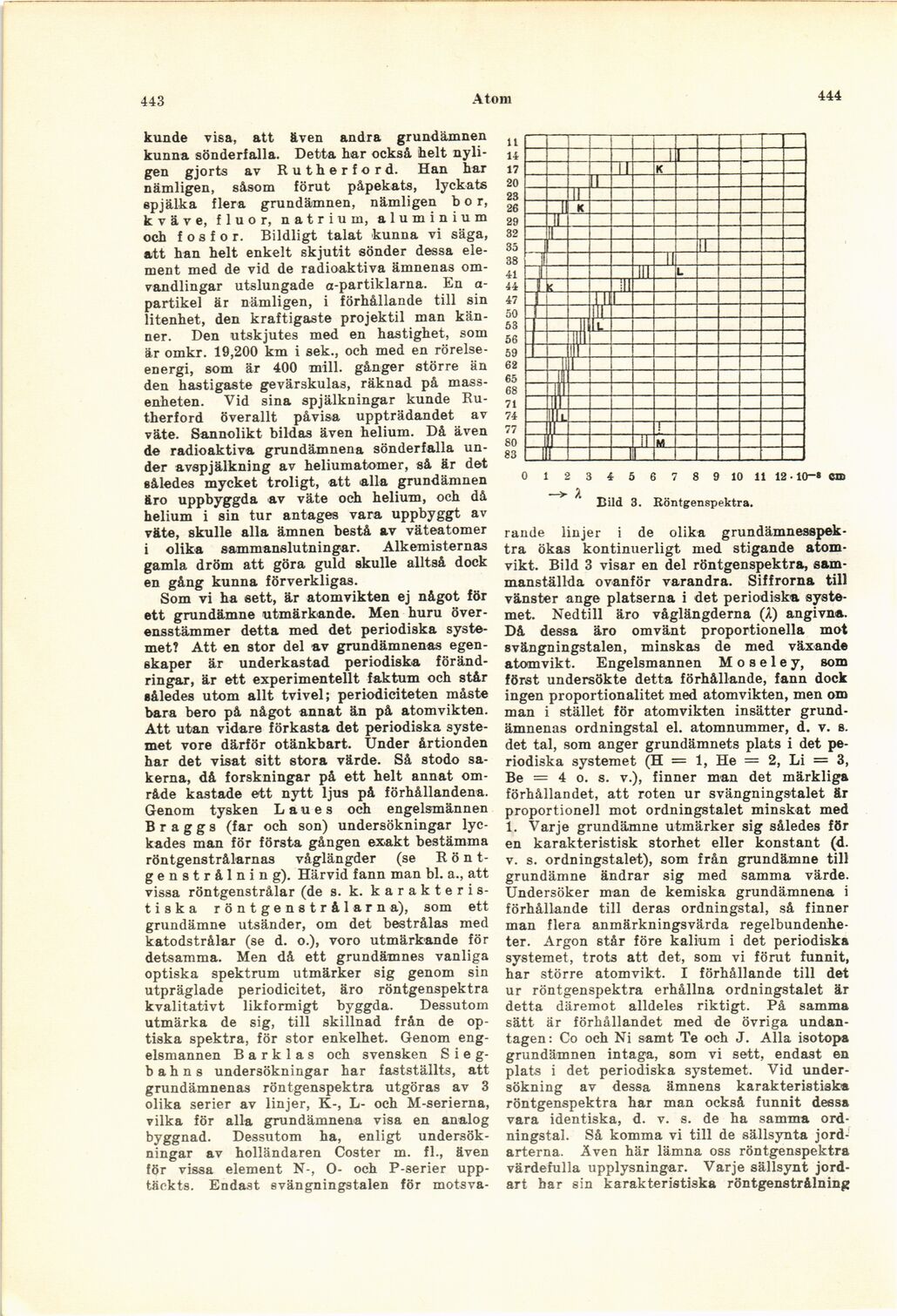
Bild 3. Röntgenspektra.
rande linjer i de olika
grundämnesspek-tra ökas kontinuerligt med stigande
atomvikt. Bild 3 visar en del röntgenspektra,
sammanställda ovanför varandra. Siffrorna till
vänster ange platserna i det periodiska
systemet. Nedtill äro våglängderna (Å) angivna.
Då dessa äro omvänt proportionella mot
svängningstalen, minskas de med växande
atomvikt. Engelsmannen M o s e 1 e y, som
först undersökte detta förhållande, fann dock
ingen proportionalitet med atomvikten, men om
man i stället för atomvikten insätter
grundämnenas ordningstal el. atomnummer, d. v. s.
det tal, som anger grundämnets plats i det
periodiska systemet (H = 1, He = 2, Li = 3,
Be = 4 o. s. v.), finner man det märkliga
förhållandet, att roten ur svängningstalet är
proportionell mot ordningstalet minskat med
1. Varje grundämne utmärker sig således för
en karakteristisk storhet eller konstant (d.
v. s. ordningstalet), som från grundämne till
grundämne ändrar sig med samma värde.
Undersöker man de kemiska grundämnena i
förhållande till deras ordningstal, så finner
man flera anmärkningsvärda
regelbundenheter. Argon står före kalium i det periodiska
systemet, trots att det, som vi förut funnit,
har större atomvikt. I förhållande till det
ur röntgenspektra erhållna ordningstalet är
detta däremot alldeles riktigt. På samma
sätt är förhållandet med de övriga
undantagen: Co och Ni samt Te och J. Alla isotopa
grundämnen intaga, som vi sett, endast en
plats i det periodiska systemet. Vid
undersökning av dessa ämnens karakteristiska
röntgenspektra har man också funnit dessa
vara identiska, d. v. s. de ha samma
ordningstal. Så komma vi till de sällsynta
jordarterna. Även här lämna oss röntgenspektra
värdefulla upplysningar. Varje sällsynt
jordart bar sin karakteristiska röntgenstrålning
<< prev. page << föreg. sida << >> nästa sida >> next page >>