
Full resolution (JPEG) - On this page / på denna sida - H. 33. 13 september 1955 - Separering av tantal och niob, av SHl
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
13 september 1955
741
Tabell 3. Extraktion med 12 N HCl av tantal- och
niob-pentaklorid ur diisobutylketon försatt med en annan
ali-fatisk keton
Tillsatt Extraherat Separa-
keton tantal niob tions
vol-"»/o °/o »/» faktor
Ingen ................ ..... 0 94,1 66,5 8,1
Acetonylaceton ...... ..... 16,5 94,0 89,2 1,9
28.5 95,2 89,7 2,3
Dietylketon .......... ..... 16,5 92,1 35,7 21,0
Diisopropylketon ...’.. ..... 16,5 94,4 29,7 39,9
Metyl-n-amylketon ... ..... 16,5 94,0 45,0 19,1
28,5 87,8 20,8 27,4
Metylisobutylketon ... ..... 16,5 94,4 47,0 19,0
28,5 93,7 25,0 44,6
Metyl-n-hexylketon .. ..... 16,5 94,6 45,6 20,9
28,5 92,6 37,7 20,7
Metylnonylketon ..... ..... 16,5 95,1 62,7 11,5
28,5 91,4 45,6 12,7
Metylisopropylketon . ..... 16,5 94,2 42,2 22,2
28,5 93,1 33,0 27,4
Vid extraktion av en järnfri pentakloridlösning går minsta
mängd niob över i vattenfasen vid ett volymförhållande
MiBK : DiBK på ca 0,45 medan tantals extraherbarhet
minskar relativt litet till ett minimum vid MiBK : DiBK på
ca 0,7. Vid närvaro av järn förskjuts minimum för niob
till MiBK : DiBK = 0,9, medan tantals extraherbarhet är
nästan densamma för alla blandningsförhållanden.
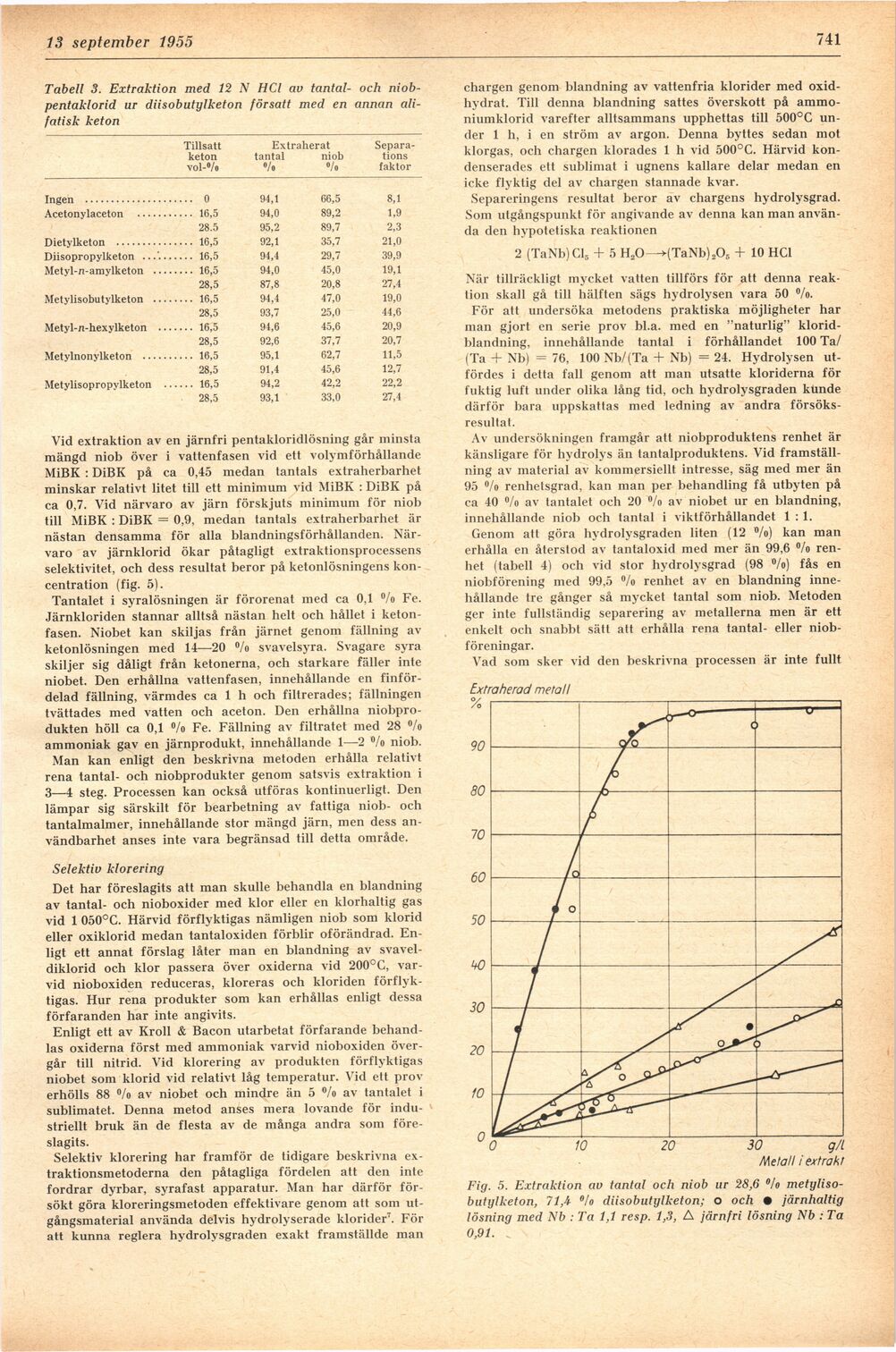
Närvaro av järnklorid ökar påtagligt extraktionsprocessens
selektivitet, och dess resultat beror på ketonlösningens
koncentration (fig. 5).
Tantalet i syralösningen är förorenat med ca 0,1 °/o Fe.
Järnkloriden stannar alltså nästan helt och hållet i
keton-fasen. Niobet kan skiljas från järnet genom fällning av
ketonlösningen med 14—20 °/o svavelsyra. Svagare syra
skiljer sig dåligt från ketonerna, och starkare fäller inte
niobet. Den erhållna vattenfasen, innehållande en
finfördelad fällning, värmdes ca 1 h och filtrerades; fällningen
tvättades med vatten och aceton. Den erhållna
niobpro-dukten höll ca 0,1 °/o Fe. Fällning av filtratet med 28 %>
ammoniak gav en järnprodukt, innehållande 1—2 °/o niob.
Man kan enligt den beskrivna metoden erhålla relativt
rena tantal- och niobprodukter genom satsvis extraktion i
3—4 steg. Processen kan också utföras kontinuerligt. Den
lämpar sig särskilt för bearbetning av fattiga niob- och
tantalmalmer, innehållande stor mängd järn, men dess
användbarhet anses inte vara begränsad till detta område.
Selektiv klorering
Det har föreslagits att man skulle behandla en blandning
av tantal- och nioboxider med klor eller en klorhaltig gas
vid 1 050°C. Härvid förflyktigas nämligen niob som klorid
eller oxiklorid medan tantaloxiden förblir oförändrad.
Enligt ett annat förslag låter man en blandning av
svavel-diklorid och klor passera över oxiderna vid 200°C,
varvid nioboxiden reduceras, kloreras och kloriden
förflyktigas. Hur rena produkter som kan erhållas enligt dessa
förfaranden har inte angivits.
Enligt ett av Kroll & Bacon utarbetat förfarande
behandlas oxiderna först med ammoniak varvid nioboxiden
övergår till nitrid. Vid klorering av produkten förflyktigas
niobet som klorid vid relativt låg temperatur. Vid ett prov
erhölls 88 °/o av niobet och mindre än 5 °/o av tantalet i
sublimatet. Denna metod anses mera lovande för
industriellt bruk än de flesta av de många andra som
föreslagits.
Selektiv klorering har framför de tidigare beskrivna
ex-traktionsmetoderna den påtagliga fördelen att den inte
fordrar dyrbar, syrafast apparatur. Man har därför
försökt göra kloreringsmetoden effektivare genom att som
utgångsmaterial använda delvis hydrolyserade klorider7. För
att kunna reglera hydrolysgraden exakt framställde man
chargen genom blandning av vattenfria klorider med
oxid-hydrat. Till denna blandning sattes överskott på
ammo-niumklorid varefter alltsammans upphettas till 500°C
under 1 h, i en ström av argon. Denna byttes sedan mot
klorgas, och chargen klorades 1 h vid 500°C. Härvid
kondenserades ett sublimat i ugnens kallare delar medan en
icke flyktig del av chargen stannade kvar.
Separeringens resultat beror av chargens hydrolysgrad.
Som utgångspunkt för angivande av denna kan man
använda den hypotetiska reaktionen
2 (TaNb) Cl3 + 5 H20—»-(TaNb)205 + 10 HCl
När tillräckligt mycket vatten tillförs för att denna
reaktion skall gå till hälften sägs hydrolysen vara 50 %.
För att undersöka metodens praktiska möjligheter har
man gjort en serie prov bl.a. med en "naturlig"
klorid-blandning, innehållande tantal i förhållandet 100 Ta/
(Ta + Nb) = 76, 100 Nb/(Ta + Nb) = 24. Hydrolysen
utfördes i detta fall genom att man utsatte kloriderna för
fuktig luft under olika lång tid, och hydrolysgraden kunde
därför bara uppskattas med ledning av andra
försöksresultat.
Av undersökningen framgår att niobproduktens renhet är
känsligare för hydrolys än tantalproduktens. Vid
framställning av material av kommersiellt intresse, säg med mer än
95 %> renhetsgrad, kan man per behandling få utbyten på
ca 40 °/o av tantalet och 20 °/o av niobet ur en blandning,
innehållande niob och tantal i viktförhållandet 1:1.
Genom att göra hydrolysgraden liten (12 °/o) kan man
erhålla en återstod av tantaloxid med mer än 99,6 %
renhet (tabell 4) och vid stor hydrolysgrad (98 %>) fås en
niobförening med 99,5 °/o renhet av en blandning
innehållande tre gånger så mycket tantal som niob. Metoden
ger inte fullständig separering av metallerna men är ett
enkelt och snabbt sätt att erhålla rena tantal- eller
niob-föreningar.
Vad som sker vid den beskrivna processen är inte fullt
Fig. 5. Extraktion av tantal och niob ur 28,6 °/o
metyliso-butylketon, 71,4 °!o diisobutylketon; o och • järnhaltig
lösning med Nb : Ta 1,1 resp. 1,3, A järnfri lösning Nb : Ta
0,91. _
<< prev. page << föreg. sida << >> nästa sida >> next page >>