
Full resolution (JPEG) - On this page / på denna sida - Sidor ...
<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has never been proofread. / Denna sida har aldrig korrekturlästs.
Termiska egenskaper hos lasta, flytande och gasformiga ämnen
kokpunktens absoluta temperatur (Tkp)
tillnärmelsevis lika stort för alla vätskor
Jcal_
k mol. anod
M T
= b
För flertalet vätskor ligger konstanten b.
vid atmosfärtryck, mellan 20 och 21
kcal/kmol.grad. Undantag är bl. a. vat*
ten med b = 25,9, etylalkohol med b = 24,0
och metylalkohol med fc» = 25,4.
Gaser och ångor
Ånga användes som beteckning på en
gas, som befinner sig i närheten av kon*
densationspunkten, och i synnerhet om
denna ligger nära rumstemperatur eller vid
högre temperatur. Alla gaser kunna kon*
denseras om temperaturen ligger under
den kritiska.
Gasernas molvärme beror i första hand
av antalet atomer (n) i molekylen. Därvid
gäller vid rumstemperatur tillnärmelsevis
n cv kcal/kmol ’/.—cpjcv
1 3 1,57
2 5 1,40
3 6 1,33
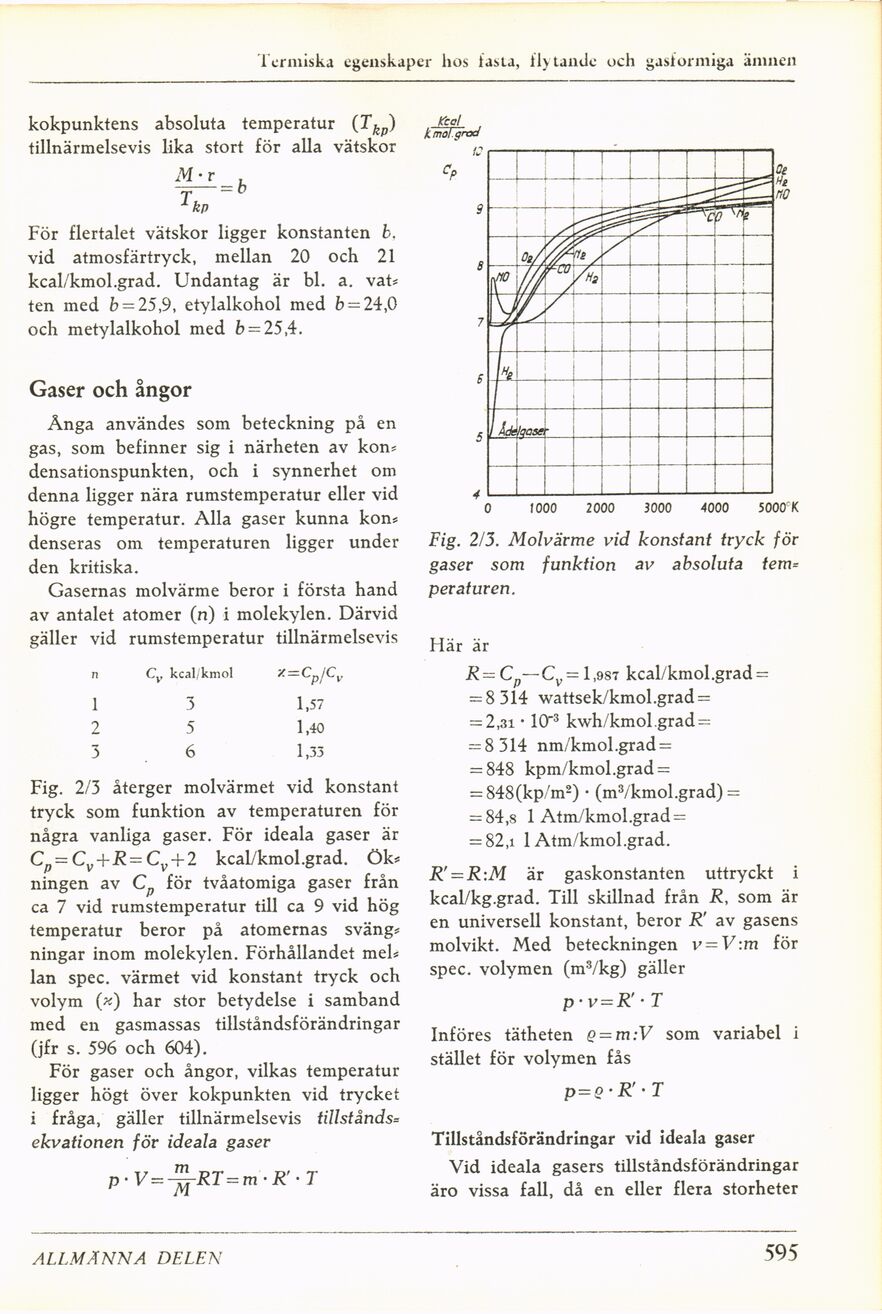
Fig. 2/3 återger molvärmet vid konstant
tryck som funktion av temperaturen för
några vanliga gaser. För ideala gaser är
Cp = Cv+R = Cv + 2 kcal/kmol.grad. Ök*
ningen av Cp för tvåatomiga gaser från
ca 7 vid rumstemperatur till ca 9 vid hög
temperatur beror på atomernas sväng*
ningar inom molekylen. Förhållandet mel*
lan spec. värmet vid konstant tryck och
volym (x) har stor betydelse i samband
med en gasmassas tillståndsförändringar
(jfr s. 596 och 604).
För gaser och ångor, vilkas temperatur
ligger högt över kokpunkten vid trycket
i fråga, gäller tillnärmelsevis tillstånds=
ekvationen för ideala gaser
p • V = ^j-RT = m • R’ • T
Fig. 213. Molvärme vid konstant tryck för
gaser som funktion av absoluta tern=
peraturen.
Här är
R- Cp—Cv= 1,987 kcal/kmol .grad =
= 8 314 wattsek/kmol.grad =
= 2,31 • 10’3 kwh/kmol grad =
= 8 314 nm/’kmol.grad =
= 848 kpm/kmol.grad =
= 848(kp/m2) • (m3/kmol.grad) =
= 84,s 1 Atm/kmol.grad =
= 82,i 1 Atm/kmol.grad.
R’ = R:M är gaskonstanten uttryckt i
kcal/kg.grad. Till skillnad från R, som är
en universell konstant, beror R’ av gasens
molvikt. Med beteckningen v = V:m för
spec. volymen (m3/kg) gäller
p-v=R’ • T
Införes tätheten Q = m:V som variabel i
stället för volymen fås
p-Q - R’ • T
Tillståndsförändringar vid ideala gaser
Vid ideala gasers tillståndsförändringar
äro vissa fall, då en eller flera storheter
ALLMÄNNA DELEN
595
<< prev. page << föreg. sida << >> nästa sida >> next page >>